基因中心在黄曲霉毒素合成关键调控因子识别机制研究方面取得新进展
近日,基因中心作物品质控制与多组学技术创新团队在黄曲霉毒素合成途径关键调控因子AflR的DNA识别机制研究方面取得新进展。相关研究成果以“Conformational Plasticity of Disordered Regions Enables Sequence-Diverse DNA Recognition by Transcription Factor AflR”为题,在线发表于国际权威期刊Nature Communications(中科院综合性期刊一区TOP,IF=15.7)。基因中心吴绍文副研究员、联合培养研究生王凤华为论文第一作者,晏石娟研究员和中科院上海高等研究院刘志军老师为共同通讯作者。
黄曲霉毒素是自然界毒性最强的化合物之一,主要污染玉米、花生等农产品,具有强致癌性。据统计,全球每年约有4.5亿吨粮食因真菌毒素污染而无法食用,造成重大经济损失并严重威胁食品安全。理解黄曲霉毒素生物合成的分子调控机制,是开发精准防控策略的关键前提。
科学问题:黄曲霉毒素“总开关”如何协同调控多个基因?
锌簇转录因子AflR是黄曲霉毒素生物合成基因簇的主调控因子,其缺失可使毒素产量降低90%以上,堪称黄曲霉毒素合成的“总开关”。遗传学研究表明,AflR需要同时调控合成基因簇中约17个生物合成基因(包括ver1、vbs、norA等关键酶基因),这些基因的启动子含有不同的DNA序列变异。这就提出了一个核心科学问题:AflR如何在识别多样化DNA序列的同时保持调控特异性?
二十多年以前,前人研究就发现AflR结合DNA回文序列(5'-TCGN₅CGA-3'),但其缺乏典型锌簇蛋白用于二聚化的螺旋结构,识别机制一直是未解之谜。阐明这一机制不仅是转录调控领域的基础科学问题,更是理解黄曲霉毒素合成调控网络的关键环节。
研究发现:揭示“结构化锚点+动态触手”的独特识别机制
研究团队针对AflR-DNA结合结构域(AflR-DBD)与三个黄曲霉毒素合成关键基因(ver1、vbs和norA)启动子的相互作用,开展了系统性研究。
(1)揭示AflR-DBD“结构化核心+动态尾巴”的独特结构
通过圆二色谱、NMR波谱和微秒级分子动力学模拟,研究发现AflR-DBD具有独特的“部分无序”特征:中心的锌簇基序保持稳定结构,而两侧N端和C端区域高度柔性。NMR弛豫实验表明,即使与DNA结合后,末端区域仍保持显著的构象可塑性——这与传统的“刚性结合”模型截然不同,为理解其多靶点识别能力提供了结构基础。
(2)发现单体化“倒位结合”的新型识别模式
通过电泳迁移实验(EMSA)和等温滴定量热法(ITC),研究证实两个AflR-DBD单体以倒位方向分别识别两个CG半位点。系统的DNA突变分析显示,ver1启动子的典型倒位序列(5'-CGGTCTCCG-3')与vbs、norA启动子的变异序列(5'-CGGN₃GCG-3')均能被有效识别,但直接重复序列(5'-CGGN₃CGG-3')则完全丧失结合能力。这种单体化倒位识别模式既保证了对黄曲霉毒素基因簇核心序列的特异性,又允许对启动子变异的适应性。
(3)解析无序区域介导的“序列适应性”分子机制
分子动力学模拟结合NMR滴定实验揭示,锌簇基序提供“锚定”功能识别CG位点,而柔性末端通过构象调整建立与不同DNA序列的分布式接触。定量EMSA实验证实,结合位点突变对不同黄曲霉毒素基因启动子的影响差异显著,直接验证了序列适应性机制。
(4)确立C端区域作为“构象枢纽”的调控作用
分子动力学模拟轨迹的主成分分析和相关网络分析显示,DNA结合后C端区域的网络中心性显著增强,成为协调整个蛋白构象变化的枢纽。截短实验表明,缺失C端或双端的AflR-DBD完全丧失DNA结合能力。Jensen-Shannon散度分析进一步揭示,C端区域的构象动力学变化具有启动子依赖性,这是AflR实现序列适应性识别的关键机制。
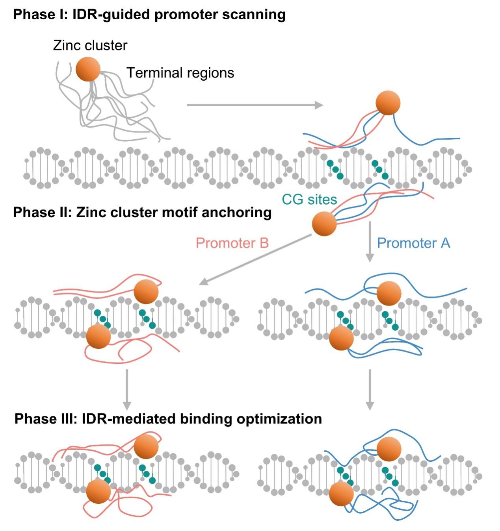
创新模型:“动态锚定”解释多基因协同调控
基于上述研究,团队提出了“动态锚定”(Dynamic-Anchor)识别模型,从分子层面阐明AflR如何同时调控黄曲霉毒素生物合成基因簇中的多个基因:
阶段I(启动子扫描):柔性末端区域通过瞬时弱相互作用快速扫描黄曲霉毒素基因簇的多个启动子区域;
阶段II(特异性锚定):结构化锌簇基序精确识别并稳定结合CG核心序列;
阶段III(适应性优化):无序区域根据不同启动子的序列差异进行构象调整,通过分布式接触网络优化每个靶基因的结合稳定性。
这一模型首次从分子层面解释了AflR如何作为“总开关”协同激活整个黄曲霉毒素生物合成通路,解决了长期困扰该领域的科学问题。
研究意义:为精准抑制黄曲霉毒素合成提供理论基础
本研究揭示的“有序-无序”协同识别机制代表了转录因子-DNA相互作用的新范式。真核生物中超过80%的转录因子含有内在无序区域,本研究建立的整合NMR、分子动力学模拟和生化验证的研究体系,可推广至其他真菌毒素调控因子的机制解析。研究明确了AflR参与不同DNA结合的关键位点,为开发靶向抑制黄曲霉毒素合成的高选择性抑制剂提供了结构基础和靶点,为推动黄曲霉毒素污染源头防控策略的开发提供了重要理论基础。
该研究得到广东省农业科学院“杰出青年”、国家自然科学基金、广东省自然科学基金等多个科研项目的资助。
原文链接:https://www.nature.com/articles/s41467-025-63926-w

 手机版
手机版

 微信
微信



